Hier ein Beitrag zur
Herstellung des Elements Silizium.
Urspruenglich wurde direkt Quartzsand oder Quartzpulver (vom Toepfergeschaeft) und Al wie oben verwendet, nach der Reaktionsgleichung
3 SiO
2 + 2 Al

3 Si + Al
2O
3Ueberraschenderweise war eine derartige Mischung nicht zur Zuendung zu bringen, selbst wenn eine Zuendmischung aus Natriumchlorat NaClO
3 und Aluminium verwendet wurde.
Dann entsannte ich mich der Beschreibungen in Jander & Blasius (ein exzellentes Buch),
Lehrbuch der analytischen und praeparativen anorganischen Chemie.
Hier wird die Thermitreaktion mit Schwefel ausgefuehrt, welches als Zusatztreibstoff dient, um die noetige Reaktionswaerme zu erhalten.
Die Reaktion wurde mit einem Vielfachen von 90 g Sand/Quartzpulver, 100 g Al (100 mesh), und 120 g Schwefel (gepulvert) ausgefuehrt, und in einem Blumentopf mit Wunderkerzen gezuendet. Diesesmal fand Zuendung ohne Probleme statt. Die Reaktion brauchte sicher 2 Minuten, und dehnte sich immer weiter von der Zuendungsstelle aus. Sah absolut fantastisch aus, das Ding leuchtete wie eine gleissend weisse Laterne. Leider ist das Bild unscharf, aber besser als nichts


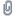 Silizium_thermit.jpg (43.62 KB . 792x632 - angeschaut 1283 Mal)
Silizium_thermit.jpg (43.62 KB . 792x632 - angeschaut 1283 Mal)Das Reaktionsgefaess wurde zum Abkuehlen stehen gelassen, und am naechsten Tag konnte Silizium Element in Form kleiner dunkler und mysterioesen Klumpen isoliert werden! Diese loesen sich nicht in HCl, sind sehr hart und zeigen eine glitzernde kritalline Oberflaeche.

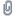 Silizium_element2.jpg (204.99 KB . 1200x1406 - angeschaut 1451 Mal)
Silizium_element2.jpg (204.99 KB . 1200x1406 - angeschaut 1451 Mal)Bei Gelegenheit koennen diese nat. gegen NaOH angetestet werden, letzteres sollte Si (im Gegensatz von HCl, HF, H
2SO
4 etc) loesen.
Dieses Silizium enthaelt wie fast alle aluminothermisch hergestellten Elemente kleine Mengen von Aluminium. Hochreines Si wird durch direkte anschliessende Reaktion mit Ar-Cl
2 (Quelle: Brauer) erreicht.
Als ein anbei: Bei der Entsorgung der Schlacke der Thermitreaktion aufpassen, sie enthaelt reichliches Aluminiumsulfid Al
2S
3, welche sich mit Wasser (zB in der Muelltonne

) gewaltige Mengen von Schwefelwasserstoff H
2S produziert. Dieses ist toxischer als Blausaeuregas, allerdings wird wegen dem Geruch kaum jemand entsprechende Mengen einatmen...
Noch ein anbei: Beim Verbrennen von ausgehaertetem Silikon (zB Fensterabdichtung) entsteht nat. auch SiO2, und dieses kann sonderbarerweise direkt mit Al (ohne Schwefel) zur Zuendung gebracht werden.... Ich schaetze das liegt wohl an der extrem feinen Form von SiO
2.