Iodessigsäure [64-69-7]
Achtung: Iodessigsäure übt eine sehr starke Ätzwirkung auf lebendes Gewebe aus (viel schlimmer als Chlor- oder Bromessigsäure). Handschuhe tragen und Hautkontakt vermeiden!
Synthesevorschrift:
Essigsäure (0,437 mol), Iod (14,1 mmol) und 14,1 mmol von CuCl (0,5 mol equiv.) – CuCl
2 * 2 H
2O (0,5 mol equiv.) werden 6 Stunden unter Stickstoff am Rückfluss erhitzt. Anschließend wird vom ausgefallenen CuI abfiltriert und aus dem Filtrat wird überschüssige Essigsäure im Vakuum abdestilliert. Der Rückstand wird aus Hexan umkristallisiert. Farblose Kristallplättchen mit Schmelzpunkt 82-84 °C. Ausbeute: 95 % der Theorie bezogen auf das eingesetzte Iod.
Auch andere Carbonsäuren lassen sich auf diese Weise in alpha-Stellung iodieren. Die Reaktion wird 120 °C durchgeführt, teilweise mit längeren Reaktionszeiten (7 Stunden für Buttersäure – Ausbeute 85 %).
Es lassen sich auch andere Kupfersalze einsetzen, die CuCl (0,5 mol equiv.) – CuCl
2 * 2 H
2O (0,5 mol equiv.)-Mischung ist jedoch am reaktivsten. Bei der Iodierung von Essigsäure wurden zB. folgende Werte gefunden:
Cu(OAc)
2 * 2 H
20 (1 mol equiv.): Reaktionszeit 40 Stunden – Ausbeute 80 %
CuCl
2 * 2 H
2O (1 mol equiv.): Reaktionszeit 13 Stunden – Ausbeute 72 %
Für mehr Details siehe Paper unter „Quelle“.
Versuch:350,0 ml Essigsäure (6,106 mol), 50,0 g Iod (197 mmol), 16,8 g CuCl
2 * 2 H
2O (98,5 mmol) und 9,8 g CuCl (98,5 mmol) wurden 8 Stunden unter Argon am Rückfluss gekocht. Auch nach dieser Zeit waren noch immer Iod-Dämpfe sichtbar (außerdem hatte sich viel Iod im Kühler niedergeschlagen). Anschließend wurde vom ausgefallenen Feststoff abfiltriert und aus dem Filtrat wurde überschüssige Essigsäure im Vakuum abdestilliert. Der Rückstand, welcher noch Kupfersalze enthielt, wurde wiederholt mit Petrolether aufgekocht und filtriert (bis sich aus dem Filtrat keine Kristalle mehr abgeschieden haben), hierzu waren etwa 700 ml Petrolether notwendig. Aus den vereinigten Filtraten wurde durch Einengen eine zweite, verunreinigte Produktfraktion gewonnen. Es hat sich aber gezeigt, dass sich der Auwand kaum lohnt. Weiße Kristallblättchen mit stechendem Geruch. Reine Fraktion: 9,3 g. 2 te Fraktion: 0,6 g. Insgesamt: 9,9 g (27 % der Theorie – gerechnet wie im Paper: 1mol Iod

1 mol Iodessigsäure). Schmelzpunkt: 80 – 81 °C (80 – 82 °C nach Datenblatt von Merck).
Die Edukte: Kupfer(I)-chlorid, Iod, Kupfer(II)-chlorid.

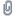 iodessigsaeure02.jpg (111.12 KB . 1151x768 - angeschaut 1099 Mal)
iodessigsaeure02.jpg (111.12 KB . 1151x768 - angeschaut 1099 Mal)Die Reaktion.

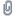 iodessigsaeure03.JPG (97.38 KB . 1151x768 - angeschaut 750 Mal)
iodessigsaeure03.JPG (97.38 KB . 1151x768 - angeschaut 750 Mal)Ende der Reaktion.

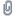 iodessigsaeure04.jpg (113.01 KB . 1151x768 - angeschaut 762 Mal)
iodessigsaeure04.jpg (113.01 KB . 1151x768 - angeschaut 762 Mal)Ein paar Kristalle in Petrolether.

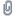 iodessigsaeure05.jpg (88.31 KB . 1151x767 - angeschaut 797 Mal)
iodessigsaeure05.jpg (88.31 KB . 1151x767 - angeschaut 797 Mal)Die reine Produktfraktion.

 iodessigsaeure06.jpg (164.07 KB . 1151x767 - angeschaut 825 Mal)Anmerkungen:
iodessigsaeure06.jpg (164.07 KB . 1151x767 - angeschaut 825 Mal)Anmerkungen:Alle festen Reagenzien wurden fein gemörsert.
Das Kupfer(I)-chlorid wurde hergestellt nach
7758-89-6-A (
http://www.lambdasyn.org/synfiles/kupferchlorid.htm). Das Produkt wurde mit viel destilliertem Wasser und mit Diethylether gewaschen, kurz im Vakuum getrocknet und anschließend eingesetzt. Es war leicht oxidiert und nicht ganz trocken. Weil sowieso Wasser und Kupfer (II)-chlorid im Reaktionsgemisch vorhanden ist, wurde keine Sorgfalt darauf verwendet,besonders reines CuCl einzusetzen.
Fehlersuche:Die Ausbeute ist sehr schlecht ausgefallen – es stellt sich die Frage warum. Wasser, sowie das leicht oxidierte CuCl dürfen keinen negativen Einfluss haben. Während der Reaktion waren die Schutzgasbedingungen ausreichend. Das Kupfer(II)-chlorid (käuflich) war mit HCl verunreinigt (Farbe, Geruch). Womöglich waren noch geringe Mengen Sulfit, etc im CuCl. Das Reaktionsgemisch war grellem Sonnenlicht ausgesetzt (nicht beabsichtigt). Ich vermute, dass die Reaktion über einen Radikalmechanismus läuft. Geringe Mengen an Radikalfängern aus den Ether könnten einen negativen Einfluss haben.
…oder es liegt am Paper. Eine Frage, die ich mir gestellt habe ist: Wie kann die Ausbeute (bezogen auf das Iod) so hoch sein, wenn während der Reaktion Kuper(I)iodid (1 mol equiv. ?!) entsteht? Die Antwort ist ziemlich einfach: Ich habe nachgerechnet, und die Ausbeuten im Paper sind so berechnet, dass aus 1 mol Iod maximal 1 mol Iodssigsäure entstehen kann.
Quelle:Horiuchi, C. Akira and Satoh, J. Yasuo, A new synthesis of α-iodo carboxylic acids using iodine-copper salt, Chemistry Letters, (9), 1509-10; 1984 (nicht digitalisiert)