Hallo ihr alle,
Halogene wie zB Cl2, Br2 und I2 können Interhalogene bilden, zB IBr, ICl und BrCl. Laut
Wikipedia gibt es auch komplexere Interhalogene, zB ICl3, ClF3, BrF3 und IF3.
Im
englischem Wiki gibt es noch dazu ein paar weitere Informationen. Aber ich bemerke die Abwesenheit von Bildern, und da kann ich vielleicht aushelfen

Bei sciencemadness entstand eine
Diskussion ob das Iodbromid, welches sich scheinbar direkt aus den beiden Elementen bei RT bildet, wirklich unter diesen Bedingungen existiert - es fand ein Farbwechsel statt, aber es ist nicht klar ob dieser Farbwechsel einfach die Mischung der beiden Elemente repräsentiert (anstatt IBr).
Dieses, dachte ich, kann ich doch leicht mit meinem Zugang zu Spektrophotometern anhand der verschiedenen Absorptionsspektren untersuchen!
Bromgas wurde nach der Kaliumbromid - Salzsäure - Oxidant (Kalziumhypochlorit) Methode hergestellt. Dazu wurden zuerst 2 g KBr in 20% HCl aufgelöst, und da fing schon das erste Problem an: es löste sich schlecht. Trotzdem färbte sich die Lösung bei Zugabe von CaOCl augenblicklich rot. Mehr Brom wurde hergestellt, indem
zuerst 5g KBr in wenige ml Wasser gelöst wurde, welches in die bestehenede Bromlösung dazugegeben wurde. Nach Zugabe von mehr CaOCl wurde die Br2 Gasentwicklung heftig, und dunkelrotes Br2 kondensierte am Rand des Gefässes:

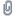 Elementares_Brom.jpg (90.97 KB . 1200x1441 - angeschaut 1470 Mal)
Elementares_Brom.jpg (90.97 KB . 1200x1441 - angeschaut 1470 Mal)Bromgas wurde direkt per Pipette in die nebenstehende Quartzküvette pipettiert (durch die Dichte des Gasses ist das möglich).
Bei Jod wurde kommerzielles Jod verwendet. Ein paar Kristalle (Spatelspitze) wurden direkt in die Küvette gegeben, jedoch waren die Joddämpfe kaum sichtbar. Deshalb wurde die Küvette samt Deckel in einen Becher mit kochendem Wasser gegeben, und die Wärme verursachte Verdampfung von I2 in sichtbaren Mengen (siehe Bld weiter unten) - eine hübsche Farbe! Um das Iodbromid zu bilden wurden dann beide Küvetten direkt aufeinandergestülpt, und die übrigbleibenden I2 Kristalle fielen in das Br2 Gas, welches augenblicklich seine kräftige Farbe verlor (siehe Bild). Das war schon sehr eindeutig dass sich in der Tat eine neue Substanz bildete.

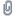 Interhalogen_IBr_IodBromid.jpg (97.54 KB . 1134x971 - angeschaut 1799 Mal)
Interhalogen_IBr_IodBromid.jpg (97.54 KB . 1134x971 - angeschaut 1799 Mal)Sowohl von elementarem Bromgas, als auch heissem Joddampf und dem Gemisch der beiden wurden Absorptionsspektren zwischen 200 und 1000 nm aufgenommen, es wurde natürlich gegen Luft normalisiert. Dieser Wellenlängenbereich deckt alles von UV bis Infrarot ab. Siehe die Spektren (IBr heiss im überschuss bedeutet, dass wie zuvor Kuvette 3 aufgewärmt wurde, womit in dem Gas I2 und IBr enthalten ist) :

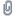 Absorption_der_Interhalogene.jpg (112.37 KB . 1079x681 - angeschaut 1757 Mal)
Absorption_der_Interhalogene.jpg (112.37 KB . 1079x681 - angeschaut 1757 Mal) Das sichtbare Spektrum wurde direkt in die Grafik eingefuegt, um den Farbunterschied zwischen I2, Br2 und IBr zu verstehen:
- Zum einen absorbiert Br2 bei RT am besten, ich gehe auch von der höchsten Konzentration aus. Es absorbiert hauptsächlich im blauen und grünen Bereich (max: 425 nm), welches hauptsächlich rot uebriglaesst, und deswegen ist Brom wohl braun

- Im Gegensatz dazu absorbiert Jod (bei 100 Grad, Spektren konnten bei RT nicht gemessen werden) mehr in der Mitte des sichtbaren Spektrums (max: 525 nm), womit Blau und rot ueberbleibt, daher die violette Farbe des Jods
- Das Iodbromid absorbiert zum einen viel weniger (obwohl sich die Konzentration des Br2 in der Kuvette nur ganz wenig reduzierte), aber vor allem verschwindet die starke Absorption von Br2 im blauen Bereich total! (425 nm)
Das heisst, wenn es sich tatsächlich
nur um eine Mischung aus elementarem Brom und Jod handeln wuerde, dann wuerde man ein Additionsspektrum (in blau, siehe Bild) bekommen. Aber unsere I2/Br2 Mischung gibt ein ganz anderes (normalisiertes) Spektrum als das einer Mischung, von daher ist der Nachweis gelungen dass sich tatsächlich eine neue Substanz, IBr, gebildet hat!
Das Spektrum von IBr is auch mehr blauverschoben, was auch wiederrum die Farbe erklärt (nicht mehr violett so wie Jod, aber uch nicht rotbraun so wie Brom)!

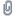 Iod-Brom+Iodbromid.jpg (100.18 KB . 1200x877 - angeschaut 1844 Mal)
Iod-Brom+Iodbromid.jpg (100.18 KB . 1200x877 - angeschaut 1844 Mal) Iodbromid ist übrigens ein Feststoff, der bei 42 Grad schmilzt... deswegen wahrscheinlich auch die wesentlich geringere Absorption als zB von Br2.